Stamceltechnologie. Modegril of therapie voor de toekomst?
- Stamceltechnologie. Modegril of therapie voor de toekomst?
- Voorwoord
- Een klein wonder
- Delen en differentiëren
- Eenrichtingsverkeer
- Van toti tot zero, een rondje Latijn
- Embryonale stamcellen
- Eeuwige groeikracht
- In-vitrofertilisatie
- Volwassen stamcellen
- Beenmerg en MAPC
- Foetale stamcellen … navelstrengbloed en andere weefsels
- Kloneren
- Therapeutisch kloneren
- Koreaanse fraude
- Hooggespannen verwachtingen
- Modelsysteem voor groei, ontwikkeling en ziekte
- Instrument voor bepaling toxiciteit
- Aangrijpingspunt voor geneesmiddelenonderzoek
- Celtherapie, de hoop
- Celtherapie, de obstakels
- Leukemie
- Huid
- Ziekte van Parkinson
- Diabetes
- Hartinfarct
- Kraakbeenletsels
- Ethische discussie over het gebruik
dossier
De laatste jaren is er erg veel te doen om die stamcellen. De media schilderen ze af als hét nieuwe tovermiddel tegen ouderdomsziekten of de garantie op een eeuwige jeugd. Dat is volgens stamcelonderzoekers niet helemaal realistisch. Stamcellen hebben zeker potentie als toekomstig geneesmiddel of als modelsysteem om de zoektocht naar nieuwe medicijnen vooruit te helpen, maar de nieuwe heilige graal zijn ze niet.
Het debat over stamcellen overstijgt ook het strikt wetenschappelijke en medische. Het mogelijk gebruik van stamcellen roept heel wat maatschappelijke, ethische-filosofische en beleidsvragen op.
Het viWTA acht het tijd om enige klaarheid te scheppen in al deze discussies. Daarom publiceert ze het dossier ‘Stamceltechnologie’.
Voorwoord
Het menselijk lichaam is samengesteld uit een gemengde verzameling van gespecialiseerde cellen. Meer dan 50.000 miljard in totaal. Een gigantisch aantal. Elk van die cellen heeft zijn eigen taak en zijn eigen specialisme.
De meeste leven korter dan wijzelf. Sommige overleven zelfs niet meer dan enkele dagen of weken. Bloed-, darm of huidcellen bijvoorbeeld. Om al die cellen te vervangen, zet ons lichaam stamcellen in. Die zitten diep verscholen in de weefsels, houden zichzelf een heel mensenleven in stand en differentiëren wanneer nodig tot een gespecialiseerde cel.
De laatste jaren is er erg veel te doen om die stamcellen.
Wellicht staat zelfs geen enkel wetenschappelijk onderzoeksveld zó in de belangstelling staat. Elke dag lees, zie of hoor je in de media wel iets over stamcellen: een nieuw type stamcel wordt ontdekt, de mogelijkheden van stamceltherapie na een hartaanval worden onderzocht, patiënten met de ziekte van Parkinson wachten ongeduldig op een stamcelbehandeling.
Het debat over stamcellen overstijgt ook het strikt wetenschappelijke en medische. Stamcellen brengen maatschappelijke, ethisch-filosofische én beleidsdiscussies teweeg. Zo vinden sommige mensen het geen goed idee om stamcellen te oogsten uit embryo’s. Ondernemers verwachten dan weer dat ze in de toekomst innovatieve celtherapieën op de markt kunnen brengen, maar voelen zich geremd door de bestaande of aankomende wetgeving. Anderen stellen zich ethische vragen als topvoetballers het navelstrengbloed van hun pasgeboren
kinderen laten invriezen in de hoop er ooit hun eigen sportblessures mee op te lappen. En de overheid tracht op te treden tegen dubieuze stamcelbehandelingen die hun effectiviteit nog niet hebben bewezen.
Stamcellen brengen echter niet alleen belofte en discussie.
In een tijdspanne van twintig jaar hebben stamcellen uit beenmerg of navelstrengbloed duizenden patiënten gered - onder hen heel wat kinderen met leukemie of aangeboren afwijkingen. Meestal was deze therapie hun enige hoop op overleven.
Het viWTA achtte het tijd om enige klaarheid te scheppen in de zin en onzin over stamcellen, in de hype en de hoop, in de redelijke voorspellingen en de ongerechtvaardigde verwachtingen. Deze brochure is een eerste stap.
Een klein wonder
“Het is een jongen!” of “Het is een meisje!” is het eerste wat de gynaecoloog een pasgeborene toeroept.
Onmiddellijk gevolgd door: “Alles zit erop en eraan”. De geboorte van een kind is telkens weer een klein wonder. De onschuld in persoon en tegelijk het grootste raadsel dat we ons kunnen voorstellen. Hoe kan op negen maanden tijd uit één cel, de versmelting van een ei- en zaadcel, een nieuwe mens ontstaan? Telkens weer opgebouwd (als alles goed is verlopen) volgens hetzelfde bouwplan: twee oren, twee ogen, twee handjes, twee voetjes, tien teentjes en tien vingertjes, een neusje ooraan, precies in het midden tussen ogen en mond.
Een mensje met spieren om te bewegen, een kloppend hart en bloedvaten, een maag- en darmstelsel, een stel hersenen om het lichaam te besturen, later op school flink te studeren en zich sociaal in te passen in een wereld met meer dan zes miljard andere mensen. Kortom, een wezen met vele duizenden miljarden cellen, die van elkaar verschillen in vorm, structuur en functie.
Maar waar haalt die ene bevruchte eicel de wijsheid vandaan om in negen maanden tijd zichzelf te ontwikkelen tot een dergelijk wonderlijk wezen?
Delen en differentiëren
Voor de ontwikkeling van bevruchte eicel tot klein mensje ‘met alles erop en eraan’, zijn twee processen onontbeerlijk: delen en differentiëren.
Binnen de dertig uur na de conceptie deelt de bevruchte eicel zich tot twee dochtercellen, vervolgens tot vier, acht, zestien cellen enzovoort. Na een viertal dagen ontstaat een ‘balletje’ van ongeveer honderd cellen, die we een blastocyst noemen. Deze blastocyst nestelt zich in de baarmoederwand, om op negen maanden tijd een baby te worden.
Delen alleen is echter onvoldoende. Het mensje dat geboren wordt, bestaat immers uit diverse verschillende weefsels met hooggespecialiseerde cellen. Die ontwikkeling van bevruchte eicel naar gespecialiseerde cel wordt door biologen differentiatie genoemd. Dit proces verloopt geleidelijk: de bevruchte eicel is nog volledig ‘ongedifferentieerd’, haar nakomelingen zullen zich stapsgewijs omvormen tot steeds verder gespecialiseerde cellen.
Eenrichtingsverkeer
De cel betaalt echter een zware prijs voor die differentiatie: eenmaal een bepaalde richting ingeslagen, is er geen weg meer terug. Zo is een volwassen levercel niet langer in staat om zich om te vormen tot een zenuwcel of een bloedcel. Een huidcel kan geen spiercel of pancreascel meer worden. De cellen verliezen als het ware de ‘potentie’ om nog langer andere celtypen te worden. Meer nog, een volwassen, volledig gespecialiseerde cel - een zenuwcel bijvoorbeeld - verliest zelfs de capaciteit om nog verder te delen.
Maar als gespecialiseerde cellen zelf niet meer kunnen delen, hoe vervangt het lichaam dan versleten en afgeleefde cellen? Darm-, huid- of bloedcellen bijvoorbeeld overleven slechts enkele dagen tot weken. Andere cellen leven langer, maar vroeg of laat is bijna elke cel aan vervanging toe.
Gelukkig beschikt het lichaam over een voorraad stamcellen.
Dat zijn cellen die eveneens afkomstig zijn van die ene bevruchte eicel, maar die minder sterk of soms zelfs heel weinig gedifferentieerd zijn. Ze zitten verscholen in de weefsels en zorgen voor de permanente regeneratie van het aftakelend lichaam.
Van toti tot zero, een rondje Latijn
Een stamcel is per definitie een cel die in staat is om zichzelf in stand te houden door zich te delen (self-renewal) maar die zich op een bepaald ogenblik ook kan differentiëren tot een meer gespecialiseerde cel.
Een stamcel die nog kan uitgroeien tot alle celtypen, noemen we totipotent. De bevruchte eicel is het prototype van de totipotente stamcel.
Andere stamcellen kunnen zich slechts ontwikkelen tot bijna alle (pluripotent), een flink aantal (multipotent) of slechts één celtype (unipotent). Tijdens de embryonale ontwikkeling en het uitgroeien in verschillende celtypen, gaat het met andere woorden steeds verder bergafwaarts met de plasticiteit van de cel: van een totipotente bevruchte eicel naar een ‘zeropotente’ gespecialiseerde cel.
Embryonale stamcellen
Totipotent zijn alleen de bevruchte eicel en de embryonale cellen tijdens de allereerste delingsstadia. We weten dat als het embryo uit acht cellen bestaat (na drie celklievingen) de cellen nog steeds totipotent zijn. Het bewijs daarvoor levert de natuur zelf in de vorm van eeneiige tweelingen. Als het heel vroege embryo zich opsplitst, ontstaan er twee genetisch identieke deelembryo’s.
Die ontwikkelen zich elk apart tot een nieuw mensje. Ook de techniek van de pre-implantatie genetische diagnostiek (PGD) is een onrechtstreeks bewijs van de totipotentie van de cellen in het achtcellig embryonale stadium. Bij PGD worden uit het embryo één of twee cellen verwijderd om na te gaan of het embryo een genetische fout draagt. De overblijvende cellen vervangen de weggenomen cellen moeiteloos en het embryo ontwikkelt zich verder op een normale manier.
Lees ook: Pre-implantatie genetische diagnostiek (PGD)
Vanaf de vijfde dag leiden opeenvolgende delingen tot een embryo dat de vorm van een ‘hol balletje’ aanneemt, de blastocyst. Die is nog steeds veel kleiner dan een speldenknop, maar de eerste ontwikkelingsverschillen tussen de cellen worden zichtbaar: de cellenlaag aan de buitenkant neemt een andere structuur aan dan de cellen aan de binnenkant. Deze vormen de zogenaamde binnenste celmassa (in het Engels inner cell mass). Het zijn de cellen van de binnenste celmassa die zich in de komende negen maanden ontwikkelen tot een baby. Alhoewel deze cellen in potentie kunnen uitgroeien tot eender welk celtype van het lichaam, noemt men ze niet langer totipotent. Immers, delen van de placenta, de vruchtvliezen en de navelstreng zijn niet afkomstig van deze cellen maar van de cellen die de buitenkant van de blastocyst vormen. Omdat cellen van de binnenste celmassa wel nog kunnen differentiëren tot de drie zogenaamde kiemlagen (endo-, meso- en ectoderm), noemt men ze pluripotent.
Eeuwige groeikracht
Het zijn deze cellen die wetenschappers aanduiden met de term embryonale stamcellen, afgekort tot ES-cellen. Om deze af te zonderen, wordt de binnenste celmassa uit de blastocyst gehaald en in kweek gebracht. De stamcelkolonies die ontstaan kan men gedurende lange tijd, zelfs eeuwig zo blijkt meer en meer, in het laboratorium verder kweken. Door een cocktail van bepaalde groeifactoren toe te voegen, differentiëren deze cellen tot verschillende typen van lichaamscellen.
In-vitrofertilisatie
In 1981 slaagde men er voor het eerst in om embryonale stamcellen van muizen af te zonderen. Daarmee was de muis het eerste zoogdier dat zijn ES-cellen vrijgaf.
Het duurde tot 1998 voor de eerste humane ES-cellijnen werden gerapporteerd. Vandaag vormen restembryo’s, die ontstaan in het kader van medisch begeleide voortplanting, de belangrijkste bron van ES-cellen. Deze embryo’s zijn het product van in-vitrofertilisatie (ivf) waarbij in het laboratorium een rijpe eicel bevrucht wordt met een zaadcel. De bevruchte eicel ondergaat in een cultuurschaaltje de eerste delingstappen, waarna het ontstane embryo wordt ingeplant in de baarmoeder.
Vaak worden echter meer eicellen bevrucht dan er werkelijk embryo’s worden teruggeplaatst bij de moeder. De overtallige embryo’s van goede kwaliteit vriest men dan in. Zo kunnen ze nadien, als de eerste ivf-ronde niet succesvol was of indien het koppel een volgend kind wil, alsnog worden ingeplant. Ouders bij wie de kinderwens vervuld is en die geen verdere zwangerschap wensen, krijgen na enige jaren de keuze over het lot van die overtallige, ingevroren embryo’s. Er zijn drie mogelijkheden:
de embryo’s doneren aan een ander (kinderloos)koppel, de embryo’s ontdooien en vernietigen, de embryo’s doneren voor wetenschappelijk onderzoek (waaronder stamcelonderzoek).
Volwassen stamcellen
De term ‘volwassen stamcel’ betekent eigenlijk meer ‘half voltooid’ dan wel echt ‘volwassen’. Als een embryo ‘klaar’ is met de vorming van alle organen en het eigenlijk alleen nog maar hoeft te worden geboren, noemt men de cellen in het embryo ‘volwassen’. De stamcellen die dan worden aangetroffen dus ook. Vandaar dat stamcellen uit foetussen of uit navelstrengbloed ook meestal het etiket ‘volwassen’ krijgen opgespeld.
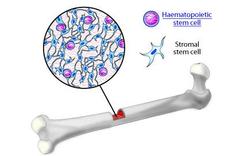
Vermoedelijk bevat elk orgaan gedurende het hele menselijke leven een kleine voorraad volwassen stamcellen. Die zorgen voor de aanvoer van ‘verse’ cellen of helpen bij het herstel als weefsels beschadigd raken. Er zijn nu alvast indicaties dat het hart, de pancreas, de spieren, de huid, de darmen, de bloedvaten, de tanden, de lever, het netvlies, de testes en de hersenen allemaal over zo’n voorraadje stamcellen beschikken. De rijkste bron van volwassen stamcellen is evenwel het beenmerg. Volwassen stamcellen zijn al een stukje gedifferentieerd en dus niet meer in staat om tot alle celtypes uit te groeien. Vandaar dat men ze multipotent (en niet langer pluripotent) noemt. Bovendien is bij de mens de regeneratiekracht van de meeste van deze stamcellen relatief beperkt, zeker als we gaan vergelijken met andere diersoorten (zie ‘Regeneratie als natuurlijk fenomeen’). Ook hebben de meeste van deze volwassen stamcellen niet meer de potentie om in het laboratorium eindeloos door te groeien. Na een aantal delingen neemt hun delingskracht gevoelig af.
Beenmerg en MAPC
Veruit de meeste ervaring hebben we op dit ogenblik met stamcellen uit beenmerg. Deze kunnen opgesplitst worden in twee categorieën: de bloedvormende en de mesenchymale stamcellen. Een bijzondere stamcel werd in 2002 door de Vlaamse onderzoekster Catherine Verfaillie ontdekt, toen ze aan de Universiteit van Minnesota (VS) werkte . Een restje beenmerg dat te lang in een kweekschaaltje was blijven staan, bevatte tot ieders verbazing nog levenskrachtige cellen. In plaats van het hele zaakje in de vuilnisbak te kieperen - hetgeen meestal gebeurt - besloot Verfaillie de cellen nog eens nader te onderzoeken. Bleek uiteindelijk dat het restje uitzonderlijk lang kon delen in kweekcultuur, dat de cellen bovendien weinig gespecialiseerd waren en nagenoeg tot elk celtype konden uitgroeien. Kortom, ze waren quasi even veelzijdig en delingskrachtig als stamcellen uit embryo’s en toch kwamen ze uit beenmerg. Verfaillie sloeg de wereld van de celbiologie met verstomming.
Deze stamcellen kregen de naam multipotente adulte progenitorcellen of MAP-cellen. Inmiddels heeft verder onderzoek aangetoond dat MAP-cellen zich niet alleen ophouden in beenmerg maar ook in de hersenen en op andere plaatsen in het lichaam. Het is nog niet helemaal duidelijk of MAP-cellen volledig ongedifferentieerde cellen zijn - die zich dus in hetzelfde stadium bevinden als embryonale stamcellen - of dat ze zich tijdens hun groei in de kweekcultuur ‘ont’-differentiëren. Maar dat ze enorm veel potentie hebben, daar is iedereen het over eens.
Foetale stamcellen … navelstrengbloed en andere weefsels
Enigszins op de wip tussen stamcellen uit echt ‘volwassen’ weefsels en uit blastocysten zitten de stamcellen afkomstig uit foetussen en navelstrengbloed. In de organen van foetussen - onder meer in de hersenen - zitten veel meer stamcellen dan een tijdje na de geboorte. Het is echter duidelijk dat het gebruik van deze stamcellen voor therapeutische doeleinden een beladen thema is, omwille van de ethische problematiek er rond. Bovendien zal ook de beschikbaarheid van stamcellen uit foetussen zeer wisselend zijn.
Minder problematisch als stamcelbron is navelstrengbloed. De bloedvormende stamcellen bevinden zich bij de geboorte immers nog niet in de beenmergholten. Ze circuleren vrijelijk door het bloed en hebben zich vooral genesteld in lever en milt. Onmiddellijk na de bevalling kan foetaal bloed dat nog in de placenta en de navelstreng is overgebleven, op een eenvoudige manier worden verzameld.
Stamcellen uit dit navelstrengbloed hebben méér groeipotentieel dan de klassieke beenmergstamcellen van volwassenen. In één ‘portie’ navelstrengbloed zitten meestal voldoende stamcellen om bijvoorbeeld het beenmerg van een kind met leukemie volledig te vervangen. Voor een volwassene met leukemie is ongeveer een drievoudige hoeveelheid nodig.
Er zijn aanwijzingen dat ook de navelstreng zelf een rijke, potentiële bron van stamcellen zou zijn. De toekomst zal dit verder uitwijzen.
Kloneren
De term kloneren slaat op het tot stand brengen van genetisch identieke organismen door middel van ongeslachtelijke voortplanting. De bekendste manier om dit te doen, is via kerntransplantatie. Dat is ook de wijze waarop Dolly en talrijke andere dieren werden gecreëerd. Men transplanteert de kern van een volwassen cel van het dier waarvan men een kopie wil maken, in een eicel waaruit de kern werd verwijderd.
Geholpen door een flinke stroomstoot slaagt de eicel er blijkbaar in om de gedifferentieerde kern van de donorcel te ‘ont’- differentiëren of te herprogrammeren.
Sommige van deze kerngetransplanteerde eicellen ontwikkelen zich tot embryo’s (blastocysten) en kunnen in de baarmoeder van een dragerdier worden geplaatst. Uit een beperkt aantal van deze embryo’s groeit een dier dat genetisch identiek is aan het dier dat zijn kern doneerde.
De hele procedure wordt reproductief kloneren genoemd. Theoretisch is de procedure ook op mensen toepasbaar.
Therapeutisch kloneren
Via deze techniek is het echter (theoretisch) ook mogelijk om van iedere persoon lichaamseigen embryonale stamcellen te produceren. Men spreekt dan van therapeutisch kloneren. De blastocyst die ontstaat na kerntransplantatie, wordt in dat geval niet teruggeplaatst in een baarmoeder maar dient als bron van embryonale stamcellen. Een volgend scenario behoort dan tot de mogelijkheden:
iemand met een degeneratieve ziekte - bv. de ziekte van Parkinson - staat een huidcel af waaruit via kerntransplantatie een blastocyst opgroeit (rechterzijde figuur). De embryonale stamcellen hieruit worden in het lab opgekweekt en gedifferentieerd tot hersencellen die bij de patiënt worden ingespoten om zijn Parkinson te behandelen. Omdat het gaat om een therapie met eigen cellen (een autologe transplantatie) bestaat er geen gevaar voor afstoting. Een tweede, evenzeer nog theoretische, mogelijkheid voor een autologe transplantatie bestaat uit de isolatie van lichaamseigen stamcellen die in het lab worden gedifferentieerd tot zenuwcellen die vervolgens worden ingeplant (linkerzijde figuur). Of deze strategie ooit mogelijk wordt met stamcellen uit beenmerg of uit andere organen, is vandaag nog lang niet duidelijk.
Koreaanse fraude
Tot nu toe is echter niemand erin geslaagd - althans voor zover bekend - om met behulp van therapeutisch kloneren een menselijke embryonale stamcellijn te maken. De Zuid-Koreaanse onderzoeker Woo-Suk Hwang heeft dat wel ooit geclaimd, maar dat bleek bedrog. Hij moest eind 2005 zijn publicaties terugtrekken en aftreden als hoogleraar aan de Universiteit van Seoul en als hoofd van het Center for Embryonic Stem Cell Research van Zuid-Korea.
De ‘zaak Hwang’ werd een van de grootste fraudezaken uit de geschiedenis van de moderne wetenschap en betekende een enorme klap voor alle stamcelonderzoekers.
Een klap die tot op de dag van vandaag nazindert.
Hooggespannen verwachtingen
De verwachtingen rond stamcellen zijn hooggespannen. Vooral de beloften rond celtherapie worden breed uitgesmeerd in de media en vinden gretig aftrek bij het brede publiek. Zeker bij patiënten en hun familieleden voor wie de hoop op een toekomstige stamceltherapie soms de enige uitweg op beterschap of genezing lijkt.
Talrijke stamcelonderzoekers geloven echter dat de werkelijke beloften van stamcellen eerder in hun gebruik liggen als modelsysteem voor het bestuderen van de menselijke embryologie en van ziekten, als instrument voor toxiciteitsonderzoek of als aangrijpingspunt voor de ontwikkeling van nieuwe geneesmiddelen. Ze denken dat dergelijke beloften veel meer binnen het bereik liggen. Daarnaast is het best mogelijk dat stamcellen nog heel andere toepassingen in zich dragen, waarvan we ons vandaag nog niet bewust zijn. Ook wetenschappers beschikken immers niet over een glazen bol om in de toekomst te kijken.
Hieronder een overzicht van wat stamcellen nú en in de toekomst kunnen brengen.
Modelsysteem voor groei, ontwikkeling en ziekte
Stamcellen kunnen fungeren als modelsysteem voor celdifferentiatie en voor de eerste fasen van de menselijke ontwikkeling. We weten nog relatief weinig over de fundamentele biologie van deze processen. Het meeste wat we weten, is afkomstig van onderzoek op menselijke embryo’s die werden afgestoten of uit experimenten met embryo’s van proefdieren, vooral muizen. Maar dat laatste heeft zijn beperkingen: muizenembryo’s verschillen nogal sterk van menselijke embryo’s wat de overdraagbaarheid van onderzoeksresultaten beperkt.
Wetenschappers hopen dat ze via embryonale en andere stamcellen nieuwe inzichten verwerven in processen als infertiliteit, spontane zwangerschapsafbreking en het ontstaan van geboortedefecten.
Stamcellen kunnen ook een in-vitromodel zijn voor diverse genetische aandoeningen en andere ziekten (zie interview met Prof. Van der Elst, pdf onderaan dit dossier). Zo kunnen cellen afkomstig van een embryo met een mutatie in het huntingtongen ons iets leren over wat er precies fout gaat in de hersencellen van patiënten met de ziekte van Huntington. Zelfs therapeutisch kloneren kan in die optiek zijn nut bewijzen: een cel van een patiënt met een (genetische) aandoening kan via kerntransplantatie omgezet worden tot een blastocyst, waaruit embryonale stamcellen worden geïsoleerd. Deze stamcellen vormen perfect studiemateriaal om na te gaan wat er op cellulair vlak fout loopt bij de patiënt.
Het valt ook niet uit te sluiten dat stamcellen ons de sleutel leveren tot een efficiëntere aanpak van kanker. Recent onderzoek toont aan dat de snelst delende en meest weerbarstige cellen in een tumor kenmerken dragen van stamcellen. Een betere kennis van stamcellen, kan een doorbraak betekenen in de behandeling van kanker.
Instrument voor bepaling toxiciteit
Stamcellen kunnen ook een bron zijn van cellen en weefsels om de veiligheid van nieuwe geneesmiddelen te testen. Vandaag kunnen nieuwe geneesmiddelen bijvoorbeeld niet op menselijke hartcellen worden getest. Eenvoudigweg omdat er geen goede hartcellijnen bestaan.
Daarom moeten geneesmiddelenonderzoekers hun toevlucht nemen tot dierlijke modellen. De werking van menselijke en dierlijke hartcellen verschilt echter sterk.
Diverse geneesmiddelen in spe zijn dan ook door preklinische testen geraakt, terwijl ze toch toxisch waren voor het menselijke hart. Soms met een fatale afloop tot gevolg. Menselijke embryonale stamcellen die men laat differentiëren
tot hartcellen (maar ook tot andere celtypen) kunnen daarom een belangrijke bijdrage leveren tot een versneld en veiliger geneesmiddelenonderzoek.
Aangrijpingspunt voor geneesmiddelenonderzoek
Stamcellen kunnen ingezet worden om specifieke groei-of beschermingsfactoren op te sporen, om concreet de nieuwe ‘epo’s’ voor lever-, hersen- of hartcellen op te sporen. Epo - de gangbare afkorting voor ‘erytropoëtine’ - is een lichaamseigen hormoon dat als sterke groeifactor de aanmaak van rode bloedcellen regelt. Ons lichaam beschikt voor elk cel- en weefseltype over een specifieke reeks hormonen en groeifactoren die op vergelijkbare wijze de celgroei reguleren. Elk van deze factoren heeft de potentie een waardevol geneesmiddel te worden dat bepaalde cellen beschermt of aanzet om te delen, vergelijkbaar met epo voor rode bloedcellen. Indien we het geschikte epo voor elke cel vinden, worden vele (vermeende) toepassingen van celtherapie overbodig, net zoals epo voor patiënten met kanker of nierproblemen de behoefte aan bloedtransfusies heeft teruggedrongen.
Naast testbank voor eiwittherapie, kunnen stamcellen ook een rol spelen in de screenings die farmaceutische bedrijven vandaag opzetten om uit hun gigantische banken met kleine moleculen biologisch actieve stoffen te selecteren.
Celtherapie, de hoop
De meest tot de verbeelding sprekende toepassing van embryonale stamcellen is cel-, transplantatie- of regeneratietherapie.
Immers, tal van belangrijke ziekten bij de mens worden veroorzaakt door het afsterven of slecht functioneren van bepaalde celtypen. Insulineproducerende cellen in de pancreas bij diabetici, neuronen die dopamine aanmaken bij de ziekte van Parkinson, retinacellen bij progressieve blindheid (retinitis pigmentosa en maculaire degeneratie), hartspiercellen na een infarct, zenuwcellen in het ruggenmerg na een dwarsleasie enzovoort.
Een succesvolle vervanging van deze cellen zou een levenslange genezing teweeg kunnen brengen. De hoop bij patiënten en familieleden op een toekomstige stamceltherapie is daarom groot, hoezeer het routinematig gebruik van elk van deze therapieën nog (verre) toekomstmuziek is. Toch bestaan ook vandaag al celtherapieën die wel succes kennen: beenmergtransplantatie is een vorm van stamceltherapie die al veertig jaar wordt toegepast bij mensen met leukemie. Dat verliep aanvankelijk met grote moeilijkheden, omdat men de immuniteitsproblemen rond afstoting onvoldoende begreep en niet kon behandelen. Vandaag kent de behandeling steeds meer succes. Ook de transplantatie van huidcellen bij brandwondenpatiënten is een voorbeeld van reeds toegepaste celtherapie, terwijl ook de routinematige behandeling van kraakbeenletsels met cellen nabij is.
Celtherapie, de obstakels
De juiste cel voor elke therapie
Geen enkele stamcelonderzoeker gelooft dat er één stamcel bestaat - embryonaal of volwassen - die de optimale stamcel is voor alle celtherapieën. Embryonale stamcellen bijvoorbeeld lijken redelijk efficiënt te differentiëren tot kloppende hartspiercellen, terwijl volwassen stamcellen hardnekkig weigeren deze differentiatiestap te zetten. Andere lichaamscellen laten zich dan wel weer gewillig kweken uit adulte stamcellen. Uiteindelijk zullen uiteenlopende factoren bij de celkeuze de doorslag geven. Daarbovenop komen nog eens de ethische (tegen)argumenten en criteria als beschikbaarheid, veiligheid van de gebruikte cellen, enzovoort.
Teratomen en kanker
Het lijkt uitgesloten dat we ooit ongedifferentieerde embryonale stamcellen als geneesmiddel zullen injecteren bij mensen. Onderzoek met proefdieren toont immers aan dat embryonale stamcellen kunnen uitgroeien tot
teratomen. Dit zijn goedaardige gezwellen die alle soorten weefselcellen bevatten: van haren, nagels en kiezen tot beenderen, stukjes darm, klieren en zenuwcellen. Voor een patiënt zou het allesbehalve prettig zijn om zo’n gezwel in zijn lever of hersenen te krijgen. Bovendien kan uit een teratoom een kwaadaardig gezwel ontstaan, een teratocarcinoom. Het gebruik van embryonale stamcellen voor therapie zal dus noodgedwongen beperkt blijven tot cellen die men in het lab voldoende laat differentiëren. Toch blijft het afwachten in hoeverre deze culturen geen ongedifferentieerde cellen meer zullen bevatten.
Bijkomend probleem is dat de cellen die men wil gebruiken voor therapie vaak gedurende lange tijd in cultuur zijn gekweekt. Hierdoor kunnen subtiele genetische veranderingen ontstaan, die het gevaar op kankervorming vergroten.
Allogeen versus autoloog
Indien vreemde stamcellen worden overgeplant in een lichaam (allogene transplantatie), kunnen ernstige tot levensbedreigende afstotingsreacties optreden. Net zoals bij een orgaantransplantatie, loopt men het gevaar dat de persoon die de celtherapie ondergaat de getransplanteerde cellen afstoot. Allogene transplantatie gaat daarom meestal gepaard met het levenslang innemen van bepaalde immuniteitsonderdrukkende medicatie. Sommige onderzoekers zien hierin argumenten om zich vooral te concentreren op autologe (lichaamseigen) celtherapie. Dit zou kunnen betekenen dat we vooral het onderzoek op volwassen stamcellen, of zelfs therapeutisch kloneren, moeten voortzetten en het onderzoek op embryonale stamcellen op een lager pitje draaien. Anderen voorspellen dan weer dat autologe transplantatie voor de meeste aandoeningen onmogelijk zal zijn bij gebrek aan geschikte of voldoende eigen stamcellen. Bovendien zou therapie met lichaamseigen stamcellen een ongewoon dure zaak worden.
Grootschalige productie zonder contaminatie
Het opgroeien van stamcellen is geen sinecure. Zo moesten embryonale stamcellen tot voor kort op een ‘feeder layer’ van muizen- of humane cellen worden gegroeid. Vandaag zijn hiervoor synthetische alternatieven beschikbaar. Grootschalige productie blijft echter gecompliceerd en bovendien zijn bijna alle tot nu toe gemaakte stamcellijnen in contact gekomen met materiaal van dierlijke oorsprong (feeder layers of foetaal kalfsserum dat aan het cultuurmedium wordt toegevoegd).
Dat maakt hen niet geschikt als ‘geneesmiddel’ voor mensen. Het gevaar op overdracht van prionen, besmettelijke virussen of andere micro-organismen is immers reëel.
Complexe aandoeningen
Stamcelonderzoekers betwijfelen of ze celtherapie ooit zullen kunnen inzetten voor meer complexe aandoeningen, waarbij diverse celtypen tegelijk worden aangetast.
Een voorbeeld is dementie, met in hoofdzaak de ziekte van Alzheimer. Bij deze aandoening gaan niet alleen massaal veel cellen van verschillende oorsprong verloren maar bovendien zorgen neerslaande eiwitketens voor het ontstaan van zogenaamde plaques en tangles in de hersenen. De vorming van deze eiwitaggregaten kan niet worden tegengegaan met celtherapie.
3D
Een ander probleem vormt het groeien van cellen in een driedimensionale structuur. Het is veel makkelijker om in het lab bloed- en huidweefsel op te kweken dan een hart, lever of een nier. Bloed is een weefsel in suspensie terwijl huid vooral een tweedimensionaal weefsel is.
Beide sluiten goed aan bij de huidige kweektechnieken in het laboratorium. Een lever opkweken vraagt naast een driedimensionale structuur ook een complexe functionele opbouw van diverse celtypen - hepatocyten, steunweefsel, bloedvaten, afvoerkanalen etc. Zowel opgroeien in 3D als het complexe samengaan van meerdere celtypen vormt voor celbiologen en weefselingenieurs nog een formidabele uitdaging.
Van bench naar bedside
Lang niet alle factoren die de groei en differentiatie van stamcellen beïnvloeden, zijn voldoende gekend om veilig en optimaal gebruik te maken van stamcellen als geneesmiddel. Er valt nog een boel fundamenteel onderzoek te verrichten, alvorens we de eigenschappen en het gedrag van stamcellen tot in de intiemste details zullen begrijpen. Sommige onderzoekers vinden het dan ook opmerkelijk hoe fundamenteel stamcelonderzoek blijkbaar achterloopt bij de klinische toepassingen. Het verdient volgens hen de voorkeur om eerst voldoende basis- en preklinisch onderzoek te verrichten (in het
laboratorium - de ‘bench’), vooraleer de stap naar de kliniek (‘bedside’) te zetten.
Leukemie
Sedert de jaren zeventig worden stamcellen, afkomstig uit beenmerg van vrijwillige donoren, gebruikt om patiënten met een ziek, vernietigd of door kanker overwoekerd beenmerg te genezen. Het principe is om via chemo- en radiotherapie het zieke beenmerg van de patiënt te vernietigen.
Daarna spuit de arts gezonde bloedvormende stamcellen van een donor in.11 Het oogsten van stamcellen bij de donor is vrij eenvoudig. Twee technieken komen in aanmerking: hetzij onder verdoving beenmerg wegnemen uit het bot van de bekkenrand, hetzij uit het bloed, na stimulatie met bepaalde groeifactoren die ervoor zorgen dat stamcellen tijdelijk uit beenmerg vrijkomen.
De transplantatie van beenmerg kan de genezingskansen van leukemiepatiënten minstens verdubbelen en vormt voor heel wat patiënten met lymfeklierkanker (lymfonen) en myeloon (ziekte van Kahler) de enige kans op genezing.
Transplantatie met bloedvormende stamcellen behoort dan ook definitief tot de routineverworvenheden van de moderne geneeskunde.
Stamcellen die aanwezig blijven in de navelstreng en de moederkoek van de pasgeboren baby, vormen eveneens een excellente bron van multipotente stamcellen. Zij kunnen zonder enig risico - noch voor de moeder, noch voor de boreling - geoogst worden. Sedert begin jaren negentig worden zij routinematig aangewend bij de behandeling van leukemie bij kinderen of ter correctie van aangeboren stoornissen van de bloedaanmaak of van het afweersysteem (immuundeficiënties).
Lees ook: Bloedkanker: leukemie
Huid
Ook de techniek om nieuwe huid te maken is ver gevorderd. Huidstamcellen van een patiënt met brandwonden kunnen in het laboratorium worden opgekweekt tot nieuwe huid. Het is mogelijk om op die manier, vertrekkend van een beperkt aantal stamcellen, toch een relatief groot verbrand huidoppervlak te behandelen.
Ziekte van Parkinson
Bij de ziekte van Parkinson sterven de zenuwcellen af die in de zwarte hersenkern (substantia nigra) de stof dopamine produceren. Dopamine is betrokken bij het doorgeven van signalen tussen zenuwcellen en is onder meer belangrijk voor een gecoördineerde spierbeweging. In het verleden is ervaring
opgedaan met transplantatie van cellen uit de hersenen van geaborteerde menselijke foetussen. De resultaten waren gemengd: sommige patiënten lieten een verbetering in het klinisch beeld zien, bij anderen verliep de regulatie van de dopamineproductie veel minder optimaal en traden ernstige bijwerkingen op. Daarnaast is er de belangrijke beperkende factor van de beschikbaarheid van voldoende foetussen en de precaire ethische situatie rond het gebruik van foetaal donormateriaal.
De ziekte van Parkinson blijft nochtans het typevoorbeeld van een neurologische aandoening waar (stam)celtherapie in de toekomst succes kan boeken.
Lees ook: Ziekte van Parkinson
Diabetes
Bij type 1-diabetes kunnen de zogenaamde ß-cellen in de pancreas geen insuline meer produceren.
De standaardtherapie bestaat uit het toedienen van bijkomende
insuline. De laatste jaren wordt bij personen met type 1-diabetes én een gestoorde nierfunctie, naast een niertransplantatie ook een pancreastransplantatie uitgevoerd. Na de transplantatie moet de patiënt medicijnen gebruiken die afstoting van de nieuwe pancreas en nier moeten voorkomen. Omdat deze geneesmiddelen op lange termijn ernstige bijwerkingen kunnen vertonen, wordt bij diabetici zonder nierfalen, slechts in heel zeldzame situaties een pancreastransplantatie overwogen.
Met het vorderen van de medische wetenschap vroeg men zich af of het niet mogelijk was de insulineproducerende ß-cellen uit de pancreas af te zonderen en rechtstreeks in te planten in de lever. Sinds enkele jaren heeft men hiermee op beperkte schaal ervaring. Ook in België werden via het Belgisch Diabetes Register patiënten op deze manier behandeld. Verder wordt op diverse plaatsen geëxperimenteerd met technieken waarbij de eilandjes worden ingepakt in een speciaal materiaal. Dit omhulsel is erop gericht om de geproduceerde insuline door te laten maar tegelijk een barrière te vormen tegen afweercellen.
De achilleshiel van deze strategie is het aanbod van menselijke alvleesklieren via donatie. Dat is vele malen kleiner dan de vraag. Mogelijk kunnen ß-cellen afgeleid van stamcellen of geïsoleerd uit donordieren (xenotransplantatie)
in de toekomst een oplossing brengen.
Hartinfarct
Bij een hartaanval gaan spiercellen verloren omdat het bloedvat dat deze spiercellen van zuurstof voorziet, geblokkeerd raakt. Zelfs indien de patiënt op korte termijn het infarct overleeft, kan de samentrekkingskracht van de hartspier toch zwaar ondermijnd zijn. Op langere termijn gaat de patiënt dan aan hartfalen lijden. Omdat de stamcellen van het hart zelf de schade blijkbaar niet spontaan kunnen herstellen, heeft men getracht stamcellen te zoeken die wel de potentie hebben zich tot functionele hartspiercellen te ontwikkelen. Hierbij wordt gedacht aan stamcellen van het hart, stamcellen uit skeletspieren en stamcellen uit beenmerg.
In het verleden werd een aantal studies opgezet waarin patiënten stamcellen (myoblasten) uit hun eigen skeletspieren kregen toegediend. Hoewel er enige verbetering van de hartspierfunctie leek op te treden, werd helemaal geen bewijs
gevonden van het feit dat de myoblasten zich omvormden tot hartspiercellen. Een bijkomende en zeer vervelende bijwerking was het ontstaan van hartritmestoornissen, waardoor een gedeelte van de patiënten medicijnen moest nemen of een interne defibrillator kreeg ingeplant.
Ook autologe stamcellen uit beenmerg worden ingezet om de hartspier te versterken na een hartinfarct.
Diverse kleinere, maar ook enkele middelgrote placebogecontroleerde klinische studies werden opgezet. Ook in België met onder meer de K.U.Leuven, het OLV-Ziekenhuis in Aalst en het Virga-Jesse Ziekenhuis in Hasselt. De resultaten van deze studies laten eerder een gemengd beeld zien. In ieder geval blijken ook hier de gebruikte stamcellen niet te differentiëren tot functionele hartspiercellen.
De huidige hypothese is dan ook dat als er al sprake kan zijn van enige functionele verbetering, die eerder te danken is aan de aangroei van nieuwe bloedvaten of het gevolg van groeifactoren die door de stamcellen worden vrijgegeven. Alleen meer fundamenteel onderzoek, meer research op diermodellen en uiteindelijk grootschaliger studies kunnen voldoende inzicht brengen in de intrinsieke meerwaarde van deze behandeling. Alleszins blijft onduidelijk welk type cellen verantwoordelijk is voor het effect, wat hun optimale dosis is, hun precieze werkingsmechanisme en het ideale tijdstip van toediening.
Lees ook: Hartfalen: oorzaken, symptomen en behandeling
Lees ook: Gebruik van automatische externe defibrillator (AED) bij hartstilstand redt levens
Kraakbeenletsels
Het principe van kraakbeentransplantaties berust op het wegnemen van gezonde kraakbeencellen bij de patiënt, het verder opkweken ervan in het laboratorium en vervolgens het implanteren ter hoogte van het kraakbeenletsel.
Daar kunnen de cellen uitgroeien tot nieuw kraakbeen. Er zijn aanwijzingen dat deze ingreep het meest zinvol is wanneer ze in een vroeg stadium van de kraakbeenafbraak gebeurt. Men verwacht dat deze behandeling in de loop van 2008 een plaats kan krijgen als gevestigde behandeling van artrose. In België zijn de afdeling reumatologie van de K.U.Leuven en het Leuvense bedrijf Tigenix pioniers op dit vlak.
Ethische discussie over het gebruik
Embryonale stamcellen worden afgezonderd uit embryo’s die zich in het blastocyststadium bevinden. Door de aard van de experimentele procedure wordt hierbij (doorgaans) het embryo vernietigd. Voor sommige mensen een stap te ver, terwijl anderen er nauwelijks graten inzien. Veel hangt af van het morele statuut dat men aan het embryo toekent. De discussie over het statuut van het embryo is echter niet nieuw. Hetzelfde debat werd de voorbije dertig jaar al meermaals gevoerd in de context van contraceptie, abortus, reproductieve geneeskunde
en andere.
Toch voegt het stamcelonderzoek een paar nieuwe dimensies toe. In de eerste plaats het principe van het ‘utilitarisme’ van het embryo: bij stamcelonderzoek en stamceltherapie wordt het embryo ‘gebruikt’ als bron van cellen, met de bedoeling om anderen te genezen. Het embryo krijgt daarmee een ‘nuttigheidsfactor’, het wordt een middel in plaats van een doel. Dit is in tegenstelling met ivf, waar het embryo op zich precies het doel is van de procedure.
Een tweede aspect is de directe (potentiële) betrokkenheid van elke persoon. Het stamcelonderzoek draagt de belofte in zich dat iedereen potentieel kan genieten van zijn vruchten. We lopen immers allemaal een risico op diabetes, hartfalen, artrose, de ziekte van Parkinson of ouderdomsblindheid. Als stamcelonderzoek voor deze aandoeningen een oplossing aandraagt, worden we er allemaal beter van. Dat gevoel was minder aanwezig tijdens het debat over abortus of zelfs bij reproductieve geneeskunde. Als het op stamcelonderzoek aankomt zijn we met andere woorden allemaal belanghebbende ‘stakeholder’).
Uiteenlopende visies
Wat betreft de toelaatbaarheid van experimenten op embryo’s in vitro en daarmee ook het isoleren van embryo nale stamcellen, stelt het Belgisch Raadgevend Comité voor Bio-Ethiek dat er grosso modo vier standpunten bestaan. (1) Experimenten op embryo’s zijn totaal ontoelaatbaar.
(2) Embryo’s in vitro (ongeacht hun oorsprong) die geen deel (meer) uitmaken van een reproductieproject, zijn voor onderzoek toegankelijk, zoals embryo’s van andere dieren, onder de voorwaarde dat ze na het experiment vernietigd worden. Nog anderen zijn van mening dat menselijke embryo’s steeds een zeker respect verdienen en dat leidt de enen tot de opvatting (3) dat alleen experimenten op ‘overtallige’ of ‘restembryo’s’ (van een stopgezet reproductieproject) toelaatbaar zijn, anderen besluiten dat (4) men ook embryo’s tot stand mag brengen met het oog op experimenten, indien de restembryo’s voor het experiment niet geschikt zijn. Bij het onderzoek van de principiële ethische opvattingen inzake het statuut van het embryo die tot deze conclusies leiden, stelt het Comité vast dat aan deze vier praktische richtlijnen geen vier duidelijke fundamentele posities beantwoorden. Bovendien wordt het opstellen van een samenhangend overzicht nog bemoeilijkt door het feit dat sommige posities alleen betrekking hebben op het embryo in vitro, terwijl andere hun fundering juist zoeken in een totaalconcept betreffende het statuut van embryo en foetus samen.
Men kan een eerste onderscheid maken tussen wat men ‘externalisten’ en ‘internalisten’ zou kunnen noemen. De eersten, ook wel aangeduid als ‘intentionalisten’, vinden dat het statuut van het embryo in vitro alleen bepaald wordt door de intenties die anderen, in casu de ouders ermee hebben. De ‘internalisten’ laten hun opvatting over het statuut vooral bepalen door karakteristieken van het embryo zelf. Men kan echter ook met de beide aspecten rekening houden.
Binnen de groep van de ‘internalisten’ kan men verschillende deelgroepen onderscheiden: er zijn de ‘essentialisten’ die vinden dat het statuut bepaald wordt door de intrinsieke kenmerken van het embryo en de ‘conventionalisten’ die beklemtonen dat het statuut bepaald wordt door conventie binnen een maatschappij. Volgens een ander criterium ziet men aan de ene kant diegenen die duidelijke scheidingslijnen vastleggen voor het ingaan van een bepaald statuut: we noemen ze ‘fixisten’, en anderen die een continue, graduele ontwikkeling vaststellen: ‘gradualisten’. (Tussen deze criteria en deelgroepen zijn tussenvormen mogelijk).
Lees ook: Registreer u als stamceldonor
Lees ook: Hoe gebeurt de afname van stamcellen?